Het Periodiek Systeem is 150: de oorsprong van een schoolvoorbeeld van ordeningsdrang
Het is dit jaar 150 jaar geleden dat Mendelejev het Periodiek Systeem der elementen ontdekte. Een icoon van het vak, maar tegelijk toonbeeld van negentiende-eeuwse chemie.
Op 17 februari 1869 laat een jonge Russische chemicus van de universiteit van Sint Petersburg tweehonderd kopieën maken van een artikel dat hij onder vakgenoten wil verspreiden. ‘Een poging tot een systeem van de elementen’, heeft Dmitri Ivanovitsj Mendelejev boven het vel papier gezet.
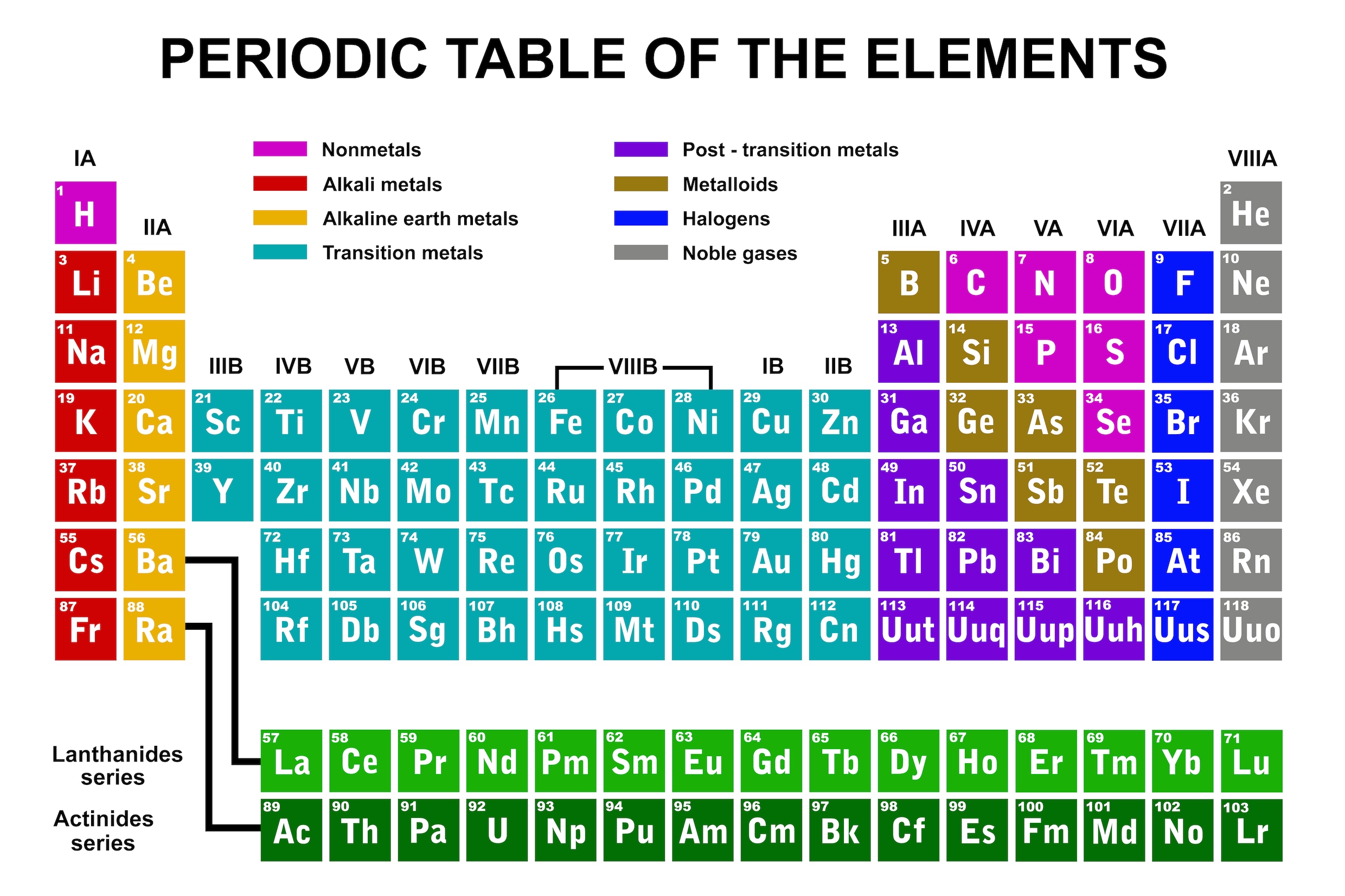
Met enige goede wil is in deze poging het ‘Periodiek Systeem der Elementen’ te herkennen zoals dat vandaag de dag in elk scheikundelokaal hangt. Het is uitgebreid en anders vormgegeven – ook Mendelejev zelf heeft er sindsdien nog aan gesleuteld – maar nu is het een icoon van het vak, misschien wel het bekendste beeld uit de wetenschap. Alle elementen uit de natuur, van waterstof en helium tot uranium (en tegenwoordig nog verder), zijn op een grote kaart geordend. Netjes op volgorde van hun gewicht, terwijl de elementen met vergelijkbare eigenschappen onder elkaar staan. Als je weet hoe het ene element zich in een chemische reactie gedraagt, ken je het gedrag van de hele kolom. Het periodiek systeem laat in een oogopslag de orde van de chemie zien.
Vooruitziende blik
Mendelejev geldt als de vader ervan, maar 150 jaar geleden dongen meer wetenschappers naar die titel. Met name de Duitse chemicus Julius Lothar Meyer claimde dat hij jaren eerder een vergelijkbaar schema had opgesteld. Maar hij had het niet gepubliceerd, en dan telt het niet in de wetenschap. Ook toen al niet.
Belangrijker nog, Mendelejev had in zijn schema gaten oningevuld gelaten en voorspeld dat daar elementen hoorden die nog moesten worden ontdekt. Toen in 1875 het bestaan van gallium werd aangetoond dat precies in het gat onder aluminium paste, en in de jaren daarna scandium en germanium andere hiaten vulden, was het pleit beslecht.
Het is anderhalve eeuw na dato lastig te achterhalen hoe Mendelejev destijds tot zijn ontdekking kwam. Wist hij dat hij een natuurlijke orde op het spoor was? Als hij in latere artikelen terugblikt op de ontstaansperiode, noemt hij zijn systeem een natuurwet die kan ijveren met de wetten van Newton. Maar uit die tijd zelf, als zijn gedachten nog authentiek zijn, is nauwelijks materiaal overgebleven. Volgens zijn boezemvriend werd de ordening Mendelejev in een visioen geopenbaard, maar geen wetenschapshistoricus die deze versie serieus neemt.

Stel eens dat iemand nu op zoek gaat naar de oorsprong van het periodiek systeem, schrijft de Amerikaanse wetenschapshistoricus Michael Gordin. Wetend dat het eind jaren zestig van de negentiende eeuw opkwam, speurt deze persoon de belangrijke chemische tijdschriften uit die tijd af. Uiteindelijk stuit hij op een artikel uit april 1869, waarin eerder genoemde ‘poging’ is opgenomen. Gordin: ‘En dan blijkt dat deze tekst voor het eerst gepubliceerd is in een handboek. Deze natuurwet, die nu in elk chemielokaal hangt waar hij als lesmateriaal voor scholieren dient, verscheen in een lesboek voor eerstejaarsstudenten.’
Dat lijkt nu misschien merkwaardig, maar was het toen zeker niet, legt hij uit. Niet alleen omdat het schrijven van handboeken destijds hoger in aanzien stond dan tegenwoordig, maar ook omdat de scheikunde halverwege de negentiende eeuw een revolutie doormaakte en er in 1869 domweg nauwelijks accurate handboeken waren. Zeker niet in het Russisch. Mendelejev, net hoogleraar geworden in Sint Petersburg, moest zelf zo’n boek schrijven waarin hij de basisideeën van het vak uiteenzette.
Een receptenboek
Mendelejev is in 1834 geboren in Siberië, heeft in datzelfde Sint Petersburg scheikunde gestudeerd waarna hij in Duitsland als onderzoeker aan de slag gaat. Zijn Duitse periode sluit hij af met een bezoek aan een groot internationaal chemiecongres dat in september 1860 in Karlsruhe wordt gehouden. Op dat congres wordt de nieuwe scheikunde in de steigers gezet.
Tot dan is het vak vaak niet veel meer dan een receptenboek. Terwijl natuurkundigen tot de kern lijken door te dringen en hun wereld in eenvoudige wetten beschrijven, is de chemie onsamenhangend. Hoe maak je nieuwe stoffen? Welke grondstoffen moet je daarvoor mengen, en in welke verhoudingen en omstandigheden? Een chemicus moet honderden formules en reacties uit zijn hoofd kennen.
De Fransman Antoine Lavoisier had eind achttiende eeuw enige orde aangebracht, onder andere door een logische naamgeving en door de introductie van het begrip element. Voor de goede orde, dat was nog niet het element in zijn huidige, atomaire vorm. Een ‘simpele substantie’ zoals Lavoisier het zelf noemde, was een stof die niet meer door een chemisch proces verder kon worden ontleed.
Hij onderscheidde 33 elementen en even leek het erop dat de scheikunde dezelfde overzichtelijkheid zou krijgen als de natuurkunde. Maar die eenvoud was van korte duur. Door een reeks van technologische ontwikkelingen, zoals de batterij, ontdekten chemici het ene na het andere element. In 1830 waren het er al vijftig en in 1860, ten tijde van het congres in Karlsruhe, stond de teller op 63. Op dat congres maakten chemici nieuwe afspraken, vooral hoe ze het gewicht van de elementen bepaalden. Dat schiep weer enige orde.

Up-to-date
Met die kennis op zak keert Mendelejev op 14 februari 1861 terug in Sint Petersburg, waar hij een aanstelling heeft gekregen als hoogleraar. Door zijn Duitse avontuur heeft hij zich in de schulden moeten steken en om aan geld te komen besluit hij een handboek over organische chemie te schrijven. Dat gaat hem goed af: hij wint er een prijs mee en een hoop geld. Aangemoedigd door dit succes begint hij aan een groter project, een leerboek over de beginselen van de scheikunde. Dat is zoals gezegd nodig ook, de scheikunde heeft zich zo sterk ontwikkeld dat een up-to-date handboek niet voorhanden is.
Het handboek bestaat uit twee delen en als hij in januari 1869 deel één naar de drukker stuurt, is van een periodiek systeem nog geen sprake. Mendelejev behandelt enkele basisdefinities en standaardexperimenten, geeft enige historische context en weidt net zo makkelijk uit over astronomie of biologie als dat hij afdwaalt naar praktische kwesties als olieraffinage of kunstmest.
Dan wijdt hij enkele paragrafen aan de vier elementen die de basis vormen van de organische chemie: waterstof, zuurstof, koolstof en stikstof. Hij sluit af met keukenzout, natriumchloride. Dat kun je splitsen in natrium en chloor, legt hij uit. Waarna hij het slothoofdstuk besteedt aan de groep waartoe chloor behoort, de halogenen (waar ook broom, fluor en jodium in zitten).
Deel één is af, schrijft Gordin, en Mendelejev heeft een probleem. Hij is halverwege zijn productie en heeft slechts 8 van de 63 elementen behandeld. Zoals hij zelf een paar maanden later schrijft, op april 1869: ‘Ik moest ze enigszins systematisch groeperen zodanig dat hun verdeling niet op toeval berustte, maar op grond van een of ander definiërend beginsel.’

Basisbouwsteen
Maar welk beginsel? De meeste scheikundigen hangen in die tijd de theorie van William Prout aan. Deze Britse chemicus heeft aan het begin van de negentiende eeuw gezien dat alle elementen een gewicht hebben dat een veelvoud is van het gewicht van waterstof. Op grond van die observatie stelt Prout dat het waterstofatoom de basisbouwsteen moet zijn van alle andere elementen.
Volgens Mendelejev is het een theorie van niks. Het is pure fictie, vindt hij. Er is geen enkel laboratoriumbewijs voor het bestaan van zo’n basale bouwsteen. Volgens hem is er maar één kenbare eigenschap waarop de elementen zijn te onderscheiden, en dat is hun gewicht. Dankzij de afspraken in Karlsruhe zijn die gewichten nu redelijk goed vastgelegd.
Maar door ze op volgorde van gewicht te leggen heeft hij nog geen systematiek. Er is nog een tweede criterium nodig. En dan heeft Mendelejev een beetje geluk, schrijft Bernadette Bensaude-Vincent in haar gezaghebbende artikel. Hij heeft al de halogenen als groep behandeld en vervolgt dan met de groep van natrium, de zogeheten alkali-metalen waartoe ook kalium en lithium behoren. ‘En dan ziet hij dat de gewichtsverschillen in beide groepen dezelfde regelmaat hebben. Als hij ze in kolommen zet, vormen ze de hoekpilaren van wat later het periodiek systeem wordt. Dat hielp hem bij het invullen van de tussenliggende ruimte.’
Het is onwaarschijnlijk dat Mendelejev toen al de reikwijdte van zijn ontdekking inzag, schrijft Gordin. ‘Anders had hij de eerste presentatie van zijn schema voor de Russische Chemische Gemeenschap niet aan een vriend overgelaten.’ Hij heeft het dan ook nog niet over een wet, en pas in het najaar van 1869 ontdekt hij dat de elementen nu niet alleen op volgorde van gewicht staan, maar dat ze ook geordend zijn in hun reactie met zuurstof – de kolommen hebben van links naar rechts een oplopende valentiewaarde, zouden we nu zeggen.
Bensaude merkt op dat er vele edities van de handboeken zijn verschenen. Mendelejev heeft er veel in gewijzigd en tal van voetnoten aangebracht, maar de volgorde en presentatie is nooit gewijzigd. ‘Als hij het periodiek systeem als zo’n dwingende voorspellende wetmatigheid zag, waarom begint hij het handboek er dan niet mee, zoals tegenwoordig gebruikelijk is?’
Pedagogische waarde
Na de gloriejaren waarin de gaten in het systeem op de door Mendelejev voorspelde manier worden opgevuld, verschijnen de eerste barsten. Dat begint met de zogeheten zeldzame aarden. Daar zijn er rond 1870 vijf van bekend en Mendelejev heeft de grootste moeite ze in zijn systeem te persen. Dat wordt er niet beter op als in de daaropvolgende decennia nóg een hele reeks van die zeldzame aarden wordt ontdekt.
Nijpend wordt het als in 1894 de Schot William Ramsay een geheel nieuw element ontdekt. Argon – de naam is afgeleid uit het Griekse woord voor inactief – past helemaal niet in Mendelejevs straatje. Zijn systematiek is immers deels gebaseerd op de reactiviteit van de elementen en dit argon – een edelgas, zeggen wij nu – doet helemaal niks. Het is geen element, verweert hij zich. Argon is volgens hem een molecuul dat is opgebouwd uit drie stikstofatomen, naar analogie van ozon dat uit drie zuurstofatomen bestaat.
Maar in 1895 komt Ramsay met een nieuw edelgas aanzetten, helium. En in de jaren daarna volgen xenon, krypton en neon. Mendelejev laat zich overtuigen. Niet in de laatste plaats omdat hij inziet dat hij zijn systeem kan redden door er een extra kolom aan toe te voegen.
Het tij is echter gekeerd. Nieuwe fenomenen zoals radioactiviteit of het elektron zagen verder aan de poten van het systeem. De integriteit van Mendelejevs visie staat bij iedere ontdekking op het spel, schrijft Gordin. Het element blijkt geen onwrikbare bouwsteen maar is zelf weer opgebouwd uit kleinere steentjes.
De kaart met het periodiek systeem heeft nog wel zijn pedagogische waarde, argumenteert Bensaude. ‘Het systeem heeft de moderne chemie zeker vooruit geholpen, maar het is er niet de voorbode van gebleken. Daarvoor is het te zeer geworteld in Mendelejevs geloof in het bestaan van individuele elementen. Het systeem hoort bij de chemie van de negentiende eeuw. Sterker nog, het kon niet anders dan aan het eind van die eeuw worden ontdekt.’
Lees ook:
Scheurtjes in het systeem
Nieuwe, opstandige atomen voegen zich niet meer naar de oude wetmatigheid